(原标题:本土医药创新投资思路逻辑示例)
医药行业极端下上的过程中,我们的观点没有发生特别大的变化:明确看好医药,看好本土创新,倾向于着力布局潜在时代徽章。本文是$青侨阳光(P000385)$ 2月月报部分节选(参考SGO大会、ASCO大会等披露数据做了部分更新)。月报节选里探讨了一家公司,文中隐去了公司名称及核心产品名称,主要是想借此实例,探讨我们对本土医药投资的一些思路与想法,以及怎样的公司对我们来说才算是“既不可替代也无法回避”。
----------------------
当下,港股上市的创药新势力已经成为基金的主投方向,持仓权重远超其它类别资产。其中包括某聚焦PD1双抗开发的创新药是基金的重点标的。按我们的理解,该公司的核心产品“格局良好、价值突出、未满足需求明确”,符合本土创新下一阶段优势品种的应有特征。但在过去2个月港股创新药械的大跌中,该公司也出现崩盘式下跌,股价从我们估值定价体系的上区间直接跌到下区间下轨附近,成为基金回撤的第一大拖累。
但按我们的理解,该公司在未来2-3年的内生价值增速会相对可观。如果同期的市场情绪也能有有所恢复,这里有概率孕育大双击机会。本文简要梳理一遍该公司的发展前景和投资逻辑,希望可以帮助大家理解青侨基金的投资标的和投资思路。
该公司成立于2012年,早年从事技术开发与转让业务,国内乐普生物已经报产的PD1单抗、科伦博泰已经报产的PDL1单抗、国外默沙东公司(MRK.N)在全球推进到3期的CTLA4单抗,最初都是该公司开发的,在IO抗体开发上有丰富的技术积累。2015年,该公司完成过亿元的A轮融资后开始推进自主开发——不过初期公司的布局风格仍然偏保守,最初是自免和肿瘤双领域、跟仿和原创双驱动,风险相对分散但重点也不突出。2019年-2020年,该公司全球首创的PD1/CTLA4双抗初期数据优异,自此之后,公司淡出biosimilar研发,放慢自免进度,并将自主开发的PD1单抗交给正大天晴做后续开发,与此同时,公司开始将内部资源向双抗项目高度集中。公司的两款全球首创的PD1双抗(PD1/CTLA4双抗和PD1/VEGF双抗)是公司的核心资产,也是我们理解公司投资价值的关键所在。
既然核心资产是PD1双抗,自然就引出两个行业层面的问题:
a、从行业方向的角度,PD1双抗的产业前景算不算开阔,临床价值够不够突出?
b、从产品性能的角度,核心产品有无性能优势,竞争格局是否良好?
在这之后,我们会进一步探讨产品的商业价值和公司的投资价值。
肿瘤治疗在过去30年发展迅猛,是制药行业里规模最大、创新最活跃的领域。背后主要来自两波系统性的技术突破:第一波突破是2000年前后开始的精准靶向治疗,诞生大量“替尼”类靶向药,针对癌症驱动基因的思路是“擒贼先擒王”、核心逻辑是“限制敌人”,有效率非常突出,但一直被耐药问题困扰,整体持久性不佳;第二波突破是2010年前后开始的肿瘤免疫治疗, PD1单抗为代表免疫疗法快速崛起,针对自身免疫系统的思路是“以不变应万变”、核心逻辑是“释放自己”,有效率虽然不高,但不容易耐药,持久性可观,而且广谱性非常突出。相比于精准靶向,免疫疗法对肿瘤治疗实践的变革更为深远——PD1单抗的出现,让大量癌种的5年生存率大幅提升,部分“超级幸存者”更是实现类治愈的效果,是过去几十年肿瘤领域最为重要的治疗革命。
PD1单抗展现的巨大潜力、以及大量资源涌入后的巨大压力,加速了肿瘤免疫疗法向更高治疗效率的探索与升级。2017-2018年前后,肿瘤免疫疗法逐渐进入到各种双重机制联用的“2.0时代”,最经典的是“PD1+CTLA4”、“PD1+化疗”、“PD1+抗血管生成”,这3类双重机制联用实实在在地提高了有效率,但也带来毒性叠加问题,难以承受继续叠加新的联用。
相比之下,双特异性抗体可以同时靶向在肿瘤组织的两个不同靶点,可以彼此富集来强化靶向性。原则上说,PD1双抗相比两个单抗的联用,可以实现“减毒增效”的效果,有机会将肿瘤免疫治疗带入到三重机制、四重机制联用的“3.0时代”。
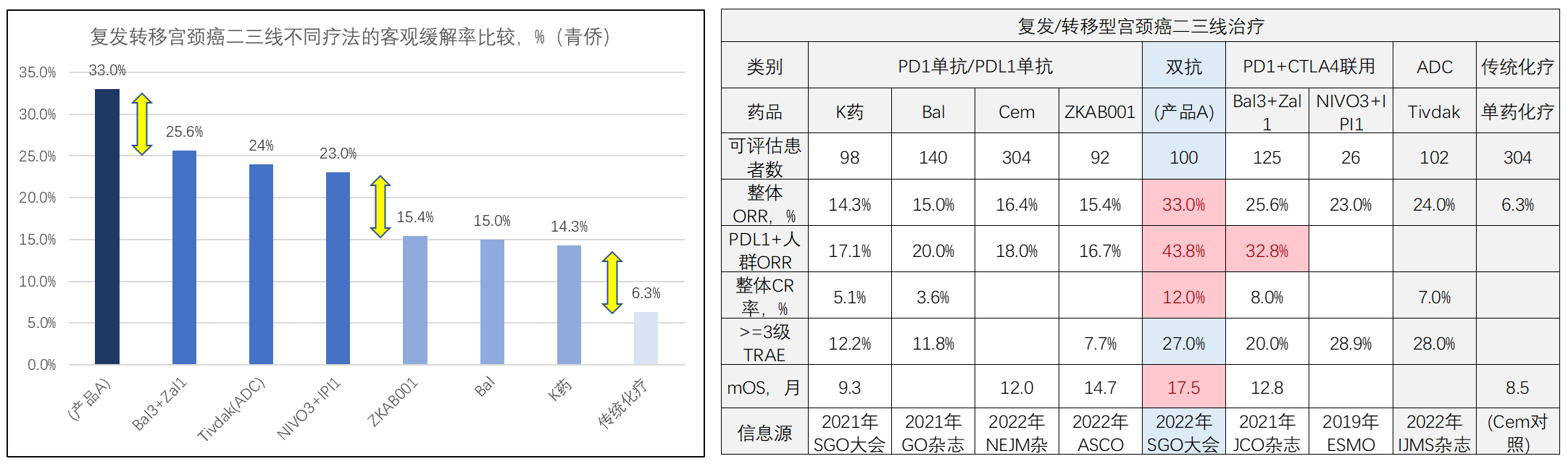
上面只是机理上的潜在可能性,最终还是需要在临床实践上得到数据证据的支撑。下面我们看一下PD1双抗在真实临床中的疗效表现,以该公司的PD1/CTLA4双抗(产品A)为例。产品A从2017年进入临床阶段,目前已经在“二三线治疗复发转移宫颈癌”和“一线治疗胃癌”2个适应症上,形成相对高可信度的大中样本量临床数据。
复发转移宫颈癌是比较难治的癌种,可选治疗方案有限。a、传统化疗的ORR仅约6%,mOS(中位生存期)也只有8个多月。b、帕博利珠(K药)在2018年获FDA批准,长期随访的ORR(客观缓解率)=14.3%、优于传统化疗,其它几款PD1/PDL1单抗长期随访ORR也都是15%-16%左右。c、“Bal3+Zal1”和“NIVO3+IPI1”是两种“PD1单抗+CTLA4单抗”的联合治疗方案,联用后ORR提升了10来个百分点ORR达到23%-26%,不过比较重要的>=3级TRAE(治疗相关的不良反应)率高了一大截。d、在此基础上,“PD1/CTLA4”双抗在并不进一步增加不良率的基础上,进一步增加了有效率,ORR进一步提升10来个百分点达到33%的水平,中位生存期超过17个月,也明显高于“PD1/PDL1单抗”或“PD1+CTLA4联用”。
这是明确的临床价值基础,该产品2021年9月国内报产获受理,并被CDE授予突破性认定,今年若能获批将成为全球首个获批的PD1双抗。另外,产品A在宫颈癌一线治疗的小样本数据中,也展现了显著优于帕博利珠(K药)的迹象。公司也已启动了一线治疗和新辅助治疗宫颈癌的3期研究,未来一线大样本数据值得期待。
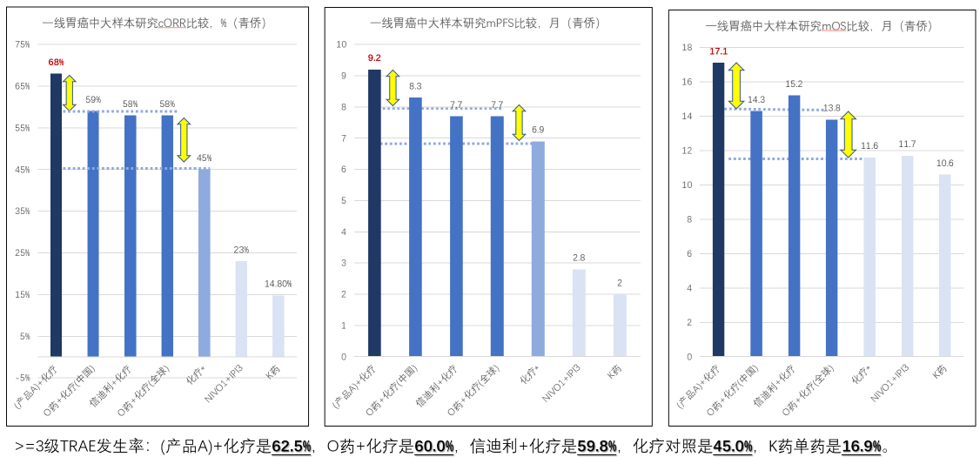
如果说只有宫颈癌单个适应症的优效潜力,还可能是癌种差异。那么该产品在胃癌一线治疗中,再次在ORR、PFS、OS上展现全面优势,则是对PD1/CTLA4双抗广谱优势的更强有力的证据支撑。胃癌是中国特色的高发大癌,也是比较难治的癌种,过去十几年胃癌新疗法的挑战大多以失败告终。包括“PD1单抗”单药、“PD1单抗+CTLA4单抗”联用,挑战一线治疗胃癌都是失败的,前者的mOS(中位生存期)还不如化疗,后者的mOS虽然赶上化疗但没有体现优效,也是失败的。
因此,胃癌免疫疗法的市场拓展都是围绕与化疗的联用。BMS的纳武利尤单抗(O药)、信达生物的信迪利单抗,在大样本3期中证明了与化疗联用后的生存获益。两者的cORR(确认的客观缓解率)提升到58%-59%,相比单独化疗提高了10多个百分点;mPFS(中位无进展生存期)提升到7.7-8.3月、相比单独化疗提高了近1个月;mOS提升到13.8-15.2月、相比单独化疗提升了2-3个月。在化疗基础上添加PD1单抗,对ORR、PFS、OS都有明确的提升,不过>=3级TRAE(治疗相关不良反应率)也从45%升到了60%,疗效提升的同时也付出了很大的安全性代价。
产品A也做了与化疗联用一线治疗胃癌的临床,实现68%的ORR、9.2月的PFS、17.1月的OS。相当于在一线化疗联用中,用双抗去替代PD1单抗,可以进一步拉高10个百分点的ORR、1-2个月的PFS、和2-3个月的OS。最重要的是,PD1/CTLA4双抗+化疗相比PD1单抗+化疗,并不显著增加额外的安全性代价(>=3级TRAE是62.5% VS 60%)——这点非常重要,如果说PD1单抗在胃癌一线通过显著牺牲安全性来提升2-3个月的中位生存期是有临床价值的;那么用双抗去替代PD1单抗,不牺牲安全性还能继续拉升2-3个月的中位生存期,显然这里的临床价值提升更为凸显。
胃癌上不同免疫疗法的疗效差异,是直观地展示我们所说的基于PD1单抗的免疫治疗3个代际差异(我们自己的定义,非公认标准):a、免疫1.0治疗,是PD1单抗单药治疗,安全性很好,但mOS可能只有10-11个月;b、 免疫2.0治疗,是PD1单抗+化疗“双重机制”治疗,mOS提高到14个月左右,但安全性牺牲很大;c、免疫3.0治疗,是“PD1+CTLA4”以双抗方式组合后再叠加化疗的“三重机制治疗”,mOS继续提高到17个月,而且这里多出来的几个月OS,几乎是在不额外增加副作用的情况下的“纯增量获益”。
我们觉得,基于PD1双抗带来的增效不增毒的“三重机制联用”,相比现在主流推进的“双重机制联用”,在临床价值上存在代际差。PD1双抗应该被看成PD1单抗的替代品或升级品,而非现在市场所认为的PD1单抗的类似物。
该公司另一款核心产品B,是2019年才进临床的PD1/VEGF双抗,已披露的严重不良反应率和不良停药率与主流PD1单抗单药数据差不多,远低于PD1单抗与VEGF单抗联用。
产品B在疗效上,也在多个小样本研究中展现出显著优于PD1单抗的潜力:
a、 对于铂耐药卵巢癌,PD1/VEGF双抗(产品B)在小样本研究中的ORR达到26.7%,相比帕博利珠、纳武利尤、阿维鲁等PD1/PDL1单抗在大样本研究中不到10%的ORR,实现了翻倍的缓解率。
b、 对于EGFR-TKI治疗失败的非小细胞肺癌,产品B在小样本研究中的ORR达到68%,比信迪利在大样本研究中实现的44%的ORR,提高了20个百分点。
c、 对于广泛期小细胞肺癌(ES-SCLC),产品B联合化疗在小样本研究中实现82%的ORR,相比阿替利珠、帕博利珠等PD1/PDL1单抗联合化疗在大样本研究中的60%-70%,也提高了10多个百分点。
d、 PD1(PDL1)单抗治疗失败的非小细胞肺癌中,产品B与多西他赛联用在小样本研究中实现了40%的ORR,PD1单抗与多西他赛治疗类似患者没有大样本研究,但估计也提高了20多个百分点。
e、在PDL1阳性的非小细胞肺癌一线治疗中,产品B在50多人的中小样本研究中实现了50%的ORR,也比K药在大样本研究中27%的ORR,也是提高了20多个百分点。
可以看到,PD1/VEGF的安全性和有效性数据,再次验证PD1双抗“减毒增效”的特性,也再次展现了PD1双抗显著优于PD1单抗的潜力。PD1/VEGF双抗,与PD1/CTLA4双抗相比,后者的优势在远端OS上、对近端的ORR提振未必很大;而前者在前期ORR上就会有大的提振,早期数据会更突出些。但不管哪个产品,都展现了相比PD1单抗的优势,也再次验证了该公司PD1双抗“减毒增效”的设计初衷。
综上,可以看到PD1双抗独有性质带来的减毒增效的特性,为基于PD1的免疫治疗,从“双重机制联用”迈向“三重机制联用”提供了空间,也为抗肿瘤疗效再上一个台阶提供了可能性。比如一线胃癌,“PD1单抗+CTLA4单抗+化疗”的三重机制联用的疗效逻辑上是好于同等剂量下“PD1单抗+化疗”的疗效,但为什么没人去做这样的三联用药方案?因为“PD1单抗+化疗”的毒性已经非常高,再叠加CTLA4单抗毒性大概率是无法承受的,比如标准的NIVO3+IPI1,与标准化疗联用,很有可能会有接近40%的患者因为无法承受不良反应而停药,大量的停药倒过来会折损整体的治疗效果,反而失去临床价值——BMS还真做过“PD1+CTLA4”联用治疗胃癌的研究,因为毒性太大、很多人中途被迫停药退组,使得早期的ORR优势没办法转化成后期的OS优势;也就是说,对BMS而言,“PD1+CTLA4”联用都已经太毒了,根本没办法再去开“PD1+CTLA4+化疗”的三联治疗的临床。但如果我们把PD1+CTLA4做成双抗后再去与化疗联用,比如用“产品A+化疗”去一线治疗胃癌,它实际上就可以在不增加额外毒性的前提下实现“PD1单抗+CTLA4单抗+化疗”三重机制联用的效果,这可以带来疗效的显著提升,这是很有临床意义的设计。
这种疗效的进一步提升,让PD1双击具备显著优于各种PD1/PDL1单抗的潜力,实现“人无我有”和“人有我精”的效果:
I. “人无我有”
PD1双抗,可以去开发PD1单抗无法开发的适应症。比如,PD1单抗已经治疗失败的耐药患者,再用PD1单抗治疗的有效率太低而失去开发意义,但PD1双抗逻辑上的反应率会高一大截,就有了开发PD1耐药后适应症的底气;再比如,针对胰腺癌这样比胃癌还难治的癌种,PD1单抗因为有效率太低很难成药,而PD1双抗的潜在有效率会高得多,成药前景变得更为可行。
II. “人有我精”
PD1双抗,可以在主流癌种上实现比PD1单抗更强劲的疗效。在PD1单抗已经开发成功的一线大癌种适应症中,PD1双抗也有机会凭借更高的有效率、更长的生存期,逐渐实现对PD1单抗的替代潜力。除了已经有高可信度中大样本量的胃癌之外,在肺癌、肝癌等多个主流癌种上,产品A和产品B在小样本研究也已经展示了相比PD1单抗显著更优的疗效潜力。
既然该公司的PD1双抗,看上去相比PD1单抗有明显的优势,为何没有海外大药企来找公司引进?为何海外很少听到PD1双抗的进展报道?
2017-2018年前后,海外对PD1双抗也爆发过不小的热情。以PD1/CTLA4双抗为例,虽然全球首个进临床的是中国的AK104,但阿斯利康的MEDI5752、Xencor的XmAb20717、Macrogenics的MGD019也都在2018年进入临床阶段。阿斯利康和礼来分别发表过PD1/CTLA4双抗、PD1/PDL1双抗的作用机理研究和详细的临床前数据,证明PD1双抗在机制上的合理性和潜在优势。不过,海外的这些早期探索,整体上的临床价值改善并不算突出,与PD1单抗未能拉出显著的代际差,在PD1单抗与其它机制的联用开发高歌猛进的背景下,逐渐被冷落。
为什么说,海外几款PD1双抗的性能改善不大?以热度最高的PD1/CTLA4双抗为例,下图是几款有安全性数据披露的PD1/CTL4双抗(KN046是PDL1/CTLA4双抗),与PD1单抗和CTLA4单抗联用的安全性比较。可以看到其它几款PD1/CTLA4双抗相比PD1+CTLA4联用,安全性有改善的倾向,但改善不是太大:
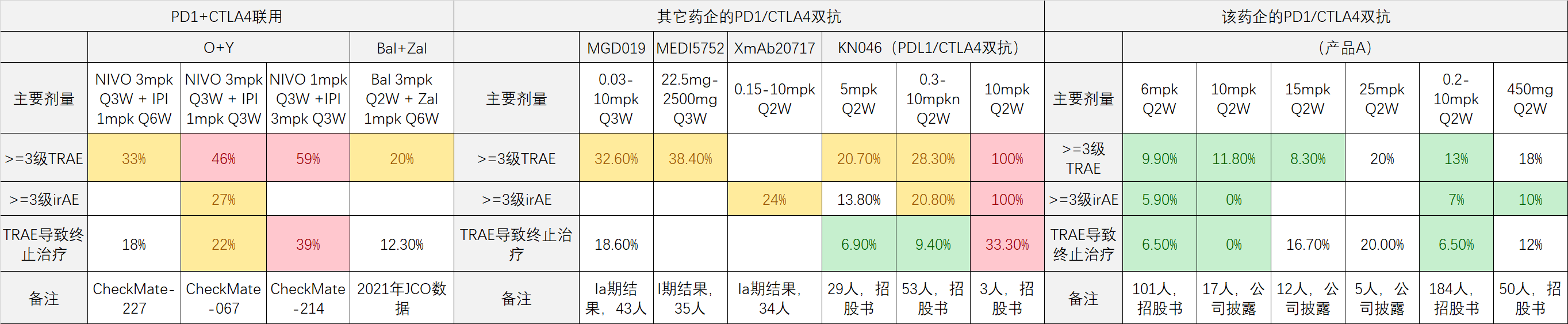
MGD019剂量爬坡到10mpk Q3W(每3周1次给药,每kg体重给药10mg,平均可能约60mg),14人中一半出现了>=3级的TRAE(大于等于3级的治疗相关的不良反应),毒性太大而不能耐受。XmAb207171未给出剂量爬坡的具体安全数据,但在10mpk 拓展研究中,最终35.5%的患者因不良终止治疗。KN046剂量爬坡到10mpk Q2W(每2周1次给药),首3个受试者100%出现>=3级TRAE。这几款产品都难以耐受10mpk剂量,即使5mpk剂量下的毒性也不低 ,留给进一步叠加联用的空间并不多。相比之下, 产品A在6mpk剂量下的安全性非常好,严重不良率仅仅与主流PD1单抗相当;即使爬坡到10mpk、15mpk、甚至25mpk剂量,不良率也只是有限提升,仍然有充足的安全冗余。
产品A的安全性优势足够凸显,完全可以通过继续增加给药剂量和继续叠加额外联用的方式来进一步变现成潜在的疗效优势。事实上,公司也是这么做的。产品A在2020年前启动的2期中最常见剂量是6mpk Q2W,还有很多是4mpk Q2W;而2020年底及之后启动的3期和部分2期研究中典型剂量都提高到了10mpk Q2W或者15mpk Q3W,相比之前的剂量有明显提升,更高的给药剂量对更高疗效也提供了必要的保证。另外,该公司的两款双抗从2021年至今,不断获批和启动与CD47单抗、VEGFR2单抗、CD73单抗、TIGIT单抗等各种互补机制的组合式联用,这些额外联用一旦被证明可以显著增加疗效而不显著增加毒性,就有可能成为未来“四重机制联用”的基础,继续推升肿瘤免疫疗法的疗效基准。
对于几款PD1/CTLA4双抗之间的疗效比较,因为缺乏重叠适应症不好直接比较。但就I期剂量爬坡的疗效数据看,产品A的疗效似乎也有占优的迹象。
同样都是“PD1/CTLA4双抗”,为何安全性上有如此大的差异?
我们的理解,双抗与ADC类似,都属于“工程化抗体”的范畴,也都涉及大量的技术细节和设计思路差异。比如,该选择怎样的靶点组合,采用什么样的结构,使用怎样比例的亲和力差异,怎么区分纯化同源和异源二聚体,怎么平衡不同的FC效应和潜在的空间位阻问题等等。
这些工艺和设计上的细节要求,让整个行业呈现“门槛长在门里头”的特性。比如多数企业觉得保留完整FC功能来杀伤表达CTLA4的免疫抑制型Treg细胞是重要的疗效基础,而该公司判断认为FC功能的保留并非功能的关键、反而带来很大的免疫相关的不良反应。最终的临床结果证明该公司的判断更合理,AK104对FC效应的消除,让它在免疫相关不良反应率上远低于保留完整FC效应的KN046等产品,也是该产品得以实现上表所展现的巨大安全性优势的基础。
海外第一批PD1/CTLA4双抗差强人意的初期数据,可能是跨国大药企对该领域缺乏热情、近年该行业竞争也未急剧增加的关键所在。对投资人来说,看到这么多同类产品性能一般,很难通过简单的逻辑推理来建立赛道信仰,最终还是要靠性能优势突出的爆款产品来建立信任。对于这点,ADC领域可能是个值得参考的先例:ADC的概念很早就已建立,但早年的探索性产品普遍性能不佳,市场热情也一度出现过明显的降温;直到近年工艺设计不断完善、开始出现性能优势突出的爆款产品,ADC赛道才重新获得广泛的认可与关注。不排除PD1双抗也需要更多的数据积累和更久的时间积累,才能获得广泛的关注与认可。但这并非都是坏事,海外竞品初期数据不佳,反过来也说明该领域在工艺和细节上的高门槛,优势产品一旦奠定地位,会更难被轻易复制、模仿和超越。在不侵犯专利权的背景下,假设复制一款性能相仿的产品都很难,在真实竞争中也谈不上PD1单抗那样的内卷风险。产品A未来能不能建立类似DS-8201那样的优势尚未可知,但至少产品A是目前全球有可查数据的PD1/CTLA4双抗中,安全性最好、疗效强于PD1单抗证据最多也是最充分的一个。这里的性能差距,明确而凸显。
而该公司的另一款核心产品产品B,则是目前全球唯一可查的临床后期阶段的PD1/VEGF双抗,即使是“唯一”,便也谈不上性能比较、更谈不上内卷。
生物科技有开放竞争的特性,同领域内的竞争优势再强,也有被跨界产品替代和冲击的风险。这样的思考是合理与必要的,从大的技术方向上,“入胞技术”是最主要的突破前沿,但肿瘤细胞快复制、高突变,并不适合基因编辑和基因疗法;基于基因修饰的CART等细胞疗法,在血液瘤中已经展现强劲疗效,但在实体瘤中的耗竭问题一直没法解决,而如果不能解决耗竭问题,那在实体瘤中即使实现PR也未必能有高的OS,这会大大限制CART在实体瘤中的临床价值和应用前景。除此之外,在前沿技术中,ADC治疗肿瘤也有很好的表现,不过除DS-8201这种极个别ADC产品外,大多ADC产品的疗效优势也没那么突出,根本不具备真正压制拥有广谱优势的PD1双抗预期空间的可能——而且,ADC和PD1双抗,两者机制不同,完全可以联用或者互为前后线。因此,基于PD1单抗或PD1双抗的免疫治疗在肿瘤治疗领域,暂时是看不到被颠覆与替代的可能性的。
另一个需要考虑的是商业化前景的问题。该公司全球首创的PD1/CTLA4双抗已经在2021年9月报产获受理,并获得CDE的突破性认定,按突破性认定的典型获批时长,预计有可能在2022年9-10月获批上市。考虑到PD1/CTLA4双抗,在临床价值上大体等同“PD1单抗+CTLA4单抗联用”的减毒增效版,假设医保局对PD1单抗的预期底线是3-4万/年,预计该产品入保价有机会获得7-8万/年或更高些的定价,在这样的定价体系下的回报预期是相对可观的。考虑到该产品在宫颈癌、胃癌上已经展现了相比PD1单抗的明显优势,在鼻咽癌、肾癌等癌种的小样本数据中也展现了明显好于PD1单抗的迹象,预计国内峰值有机会做到50亿+量级。另一款全球首创的PD1/VEGF双抗,在非小细胞肺癌、小细胞肺癌、卵巢癌等适应症的小样本数据中,也都展现了显著好于PD1单抗的优势,考虑潜在的适应症扩展,国内峰值销售额也有达到50亿量级的潜力。相比这两款产品在国内100亿+量级的商业化潜力,该公司目前市值所隐含的预期显然并未充分入价。
对于出海问题,产品A和产品B的产品性能没有问题,有具备明确的国际竞争力。只是依公司一贯稳健的文化风格而言,在国内市场尚需加速推进的当下,靠自己推进海外市场不是也不会是公司的重点(但积极寻找对外授权是个不错的选项);而等3-5年后,公司国内业务的格局逐渐稳定,到那时候公司的PD1双抗能否打开国际市场预期,会是公司价值能否有进一步扩展空间的关键所在。
最后,回到投资逻辑,公司对自己的评价是“开创了下一代免疫治疗的新格局”,按我们的理解,该公司确实有成为潜在徽章级企业的基础。但公司的估值,依然在我们的定价跟踪体系里跌到平庸公司才会到达的估值下轨。我们把“PD1双抗”看成是“PD1单抗的升级品和替代品”,而市场更多地把“PD1双抗”当成“又一款PD1类似物”,这是很大的预期差。
虽然我们觉得不合理,但从事后视角也能解释市场表现所展现的逻辑:从内因上说,PD1双抗的特性,不适合用简单的逻辑去形成赛道信仰,在情绪退潮的时候未能得到坚定的支持;从外因上说,资本市场对本土创新、对免疫疗法、对国际潜力拓展的情绪和热度都在迅速冷却,该公司正好符合了本轮港股杀逻辑的几个主要方向,受到明显的“预期连坐”。
但这里的逻辑下杀,未必代表业务层面的事实真相。“抗体产业里的工程化升级”+“行业主线上的创新转型”+“国际范围内的中国崛起”,仍然是明确而强大的时代趋势;在这种大级别力量的推动下,本土创药新势力里的佼佼者,仍然在高速推动内生价值的增长,随着数据的不断成熟和积累,公司的商业价值会越来越凸显。
创新药是强科技属性的行业,科技行业的底层逻辑是“性能为王”。从目前已披露数据看,该公司双抗产品在胃癌、宫颈癌、肺癌等多个适应症上,已经站在基于PD1的免疫疗法的全球性能顶端。我们按照历史回归总结的估值通道,可以解释主流标的90%以上的估值状态,但该公司目前的估值已经跌出估值通道,意味着该公司在我们的估值体系已经低于绝大多数市场情况对应的应有估值水平,而且按我们的理解,该公司的内生价值会以超过3年翻倍的速度迅猛增长。但现有市况下,市场对此类公司显著低估的定价与高速增长的内生价值缺乏必要的关注,或者说缺乏必要的信心。但关注与信心是可被改变的因素,现在的关注不足与信心匮乏也可以成为未来潜在双击的动力基础:
1-2年内,看公司双抗产品何时获批、如何定价、如何放量。如果该公司能够把价格定上去,同时实现高质量的快速放量(意味着性能优势得到医生的广泛认可),那么市场就可以更自然地建立“PD1双抗性能可以显著全面超越PD1单抗”的认知,市场对“PD1双抗只是PD1单抗类似物”的疑虑也会自然消解。
2-3年后,看公司何时在重点适应症上用大3期头对头的方式击败K药(或其它PD1单抗),以及看公司何时能实现海外的高价值授权。如果该公司以主流更认可的头对头大3期,在关键适应症上击败潜在的下一任全球药王、并且实现高价值的对外授权, 那么市场大概率也会对该公司另眼相看。
注:文中提到的公司及产品名称已经隐去,仅为基本面分析及逻辑探讨,不构成推荐或买卖暗示。组合内有持仓,未来一周内无买卖交易计划。上述观点未必客观,仅供参考。
