(原标题:时人当识凌云木:简析康方生物AK112+AK117对MSS CRC治疗的迭代潜力)

写在前面,康方生物AK112+AK117一直是我极为看好且关注的联用组合,这次ESMO大会披露的各项数据也是让我非常高兴,可以很清晰的看到康方生物AK112+AK117未来的光明的前景,本文背景很长,可能对非专业出身有些难度,不过我也尽量在后面进行了总结。题目中诗句原为时人不识凌云木,我觉得过于含有抱怨和攻击性了,于是稍作更改,化为了时人当识凌云木。
那么先看看背景,免疫检查点抑制剂(ICIs)的使用彻底改变了癌症治疗,尤其是在免疫炎症性肿瘤和高突变负荷的肿瘤中,如微卫星不稳定(microsatellite instable,MSI)的结直肠癌(colorectal cancer,CRC)。然而,它们在微卫星稳定型(microsatellite stable,MSS)CRC中的疗效有限,MSS CRC占了患者数并不比肺癌少多少的结直肠癌的80%以上。ICIs单药治疗或ICIs联合ICIs的组合在MSS CRC患者中显示出有限的临床活性,大多数研究中的总体反应率(ORR)低于10%。ICIs与酪氨酸激酶抑制剂(TKI)的联合治疗的ORR范围为10%至40%,并且对患者(尤其是没有活动性肝转移的患者)表现出更高的益处。ICIs与抗VEGF药物的联合治疗显示出适度的ORR,尤其是在早期治疗线和与化疗联合时。尽管这些组合可能带来适度的改善,但尚未明确定义长期获益的生物标志物。涉及BRAF抑制剂与ICIs联合的研究显示,在分子定义的亚组中,联合治疗的反应前景乐观。总之,尽管ICIs单药治疗在MSS CRC中的疗效有限,但联合治疗策略有望提高生存率。目前业内认为进一步的研究有必要以确定最佳的联合治疗方法、治疗反应的预测生物标志物,以及识别肿瘤分子特征为目的进行探索。
免疫治疗成为癌症治疗的支柱,并在过去十年中显著改变了癌症治疗的格局。免疫检查点抑制剂(ICIs)作为一种免疫治疗药物,通过调节免疫检查点释放免疫系统的“刹车”,开启了免疫治疗的新时代。ICIs的益处在免疫炎性肿瘤患者中尤为显著,如黑色素瘤、非小细胞肺癌和肾细胞癌,以及具有高突变负荷、伴随大量新抗原的肿瘤。相较之下,ICIs在免疫“冷”肿瘤和低突变负荷肿瘤患者中的疗效有限。微卫星不稳定性高(Microsatellite instability-high,MSI-H)的结直肠癌(CRC)是最早展示出ICIs益处的肿瘤之一。在使用帕博利珠单抗(K药)单药治疗的CRC患者的应答率为40%,其中大部分患者为经过多次治疗的CRC患者。而在该研究的扩展队列更新中,转移性MSI-H CRC患者的应答率超过了50%。这一疗效在更大规模的研究和长期随访中得到证实,表明MSI-H CRC患者通过ICIs可以实现高度持久的疾病控制。MSI-H CRC的肿瘤突变负荷较高,平均为46.8个突变/百万碱基对,这种由于移码突变导致的高突变负荷引发了大量新抗原的产生和表达,成为MSI-H CRC高ICIs疗效的基础。虽然ICIs已成为MSI-H CRC患者的标准治疗方法,早期研究显示,ICIs对微卫星稳定(MSS)的CRC患者,特别是ICIs单药治疗,疗效非常有限。MSS CRC的分子发病机制和肿瘤微环境(TME)与MSI CRC存在显著差异。MSS CRC的肿瘤突变负荷明显低于MSI-H CRC。此外,MSS CRC中的TME更具免疫抑制性,且免疫耗竭更加显著。
在免疫检查点抑制剂单药或双联治疗中,大多数研究的主要结果为客观缓解率(ORR),除Botensilimab单抗(CTLA-4)联合balstilimab单抗(PD-1)的组合外,所有研究的ORR均低于10%。疾病控制率(DCR)在11%到73%之间。ICI单药治疗未显示显著的临床活性,在使用K药或O药的两项研究中均未观察到客观缓解。然而,在ANICCA研究中,评估O药单药治疗肿瘤特异性主要组织相容性复合物II(tsMHC-II)阳性MSS CRC的患者中,38%的无肝转移患者在18周及以上继续接受O药单抗治疗。再看看ICIs双联治疗的临床试验。在Botensilimab单抗(CTLA-4)联合balstilimab单抗(PD-1)的研究中,ORR和DCR分别为22%和73%。更新数据中,有无活跃肝转移患者的ORR分别为0%和23%。在一项随机II期研究中,评估了度伐利尤单抗(PD-L1)联合曲美木单抗(CTLA-4)与最佳支持治疗作为对照组的疗效,其中一名MSS患者显示部分缓解(PR),持续超过21个月。在同一研究中,突变负荷较高(28Mb或以上)的患者从ICI治疗中获得了最大的OS(总生存)获益。
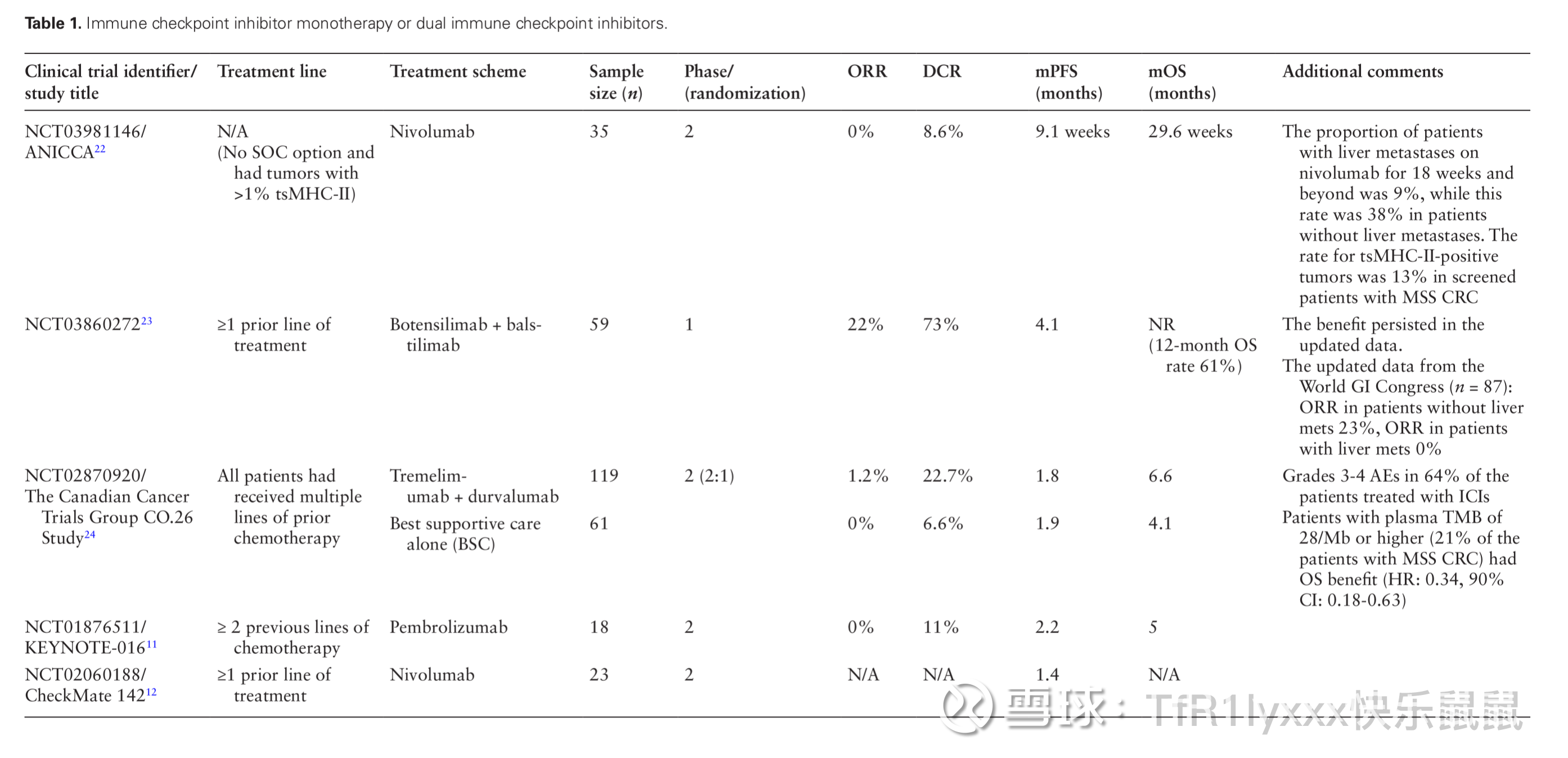
图片来源:Guven DC, Kavgaci G, Erul E, et al. The Efficacy of Immune Checkpoint Inhibitors in Microsatellite Stable Colorectal Cancer: A Systematic Review. Oncologist. 2024;29(5):e580-e600. doi:10.1093/oncolo/oyae013
在免疫检查点抑制剂与酪氨酸激酶抑制剂(TKI)组合中,瑞戈非尼(TKI)是这些研究中最常用的药物。在可用的研究中,瑞戈非尼(Regorafenib)的II期推荐剂量为80-120 mg。这些与瑞戈非尼等联用的研究的结果不一。在日本进行的Regonivo研究包括胃癌和CRC患者。对于MSS CRC患者,ORR为33.3%,而在美国进行的类似设计研究中,ORR就仅仅为7%了。此外,在Regonivo研究中,63.6%的肺部靶病灶有反应,而肝靶病灶的反应率为8.3%。类似设计的Regomune研究中,瑞戈非尼联合阿维鲁单抗(PD-L1)在48名患者中未见反应。中位无进展生存期(PFS)在LEAP-005(K药+仑伐替尼,可乐组合)研究中为2.3个月,而在Regonivo研究中为7.9个月。组合治疗的3级或更高不良事件比例不一,部分研究报告的3级或更高不良事件比例高达90%。
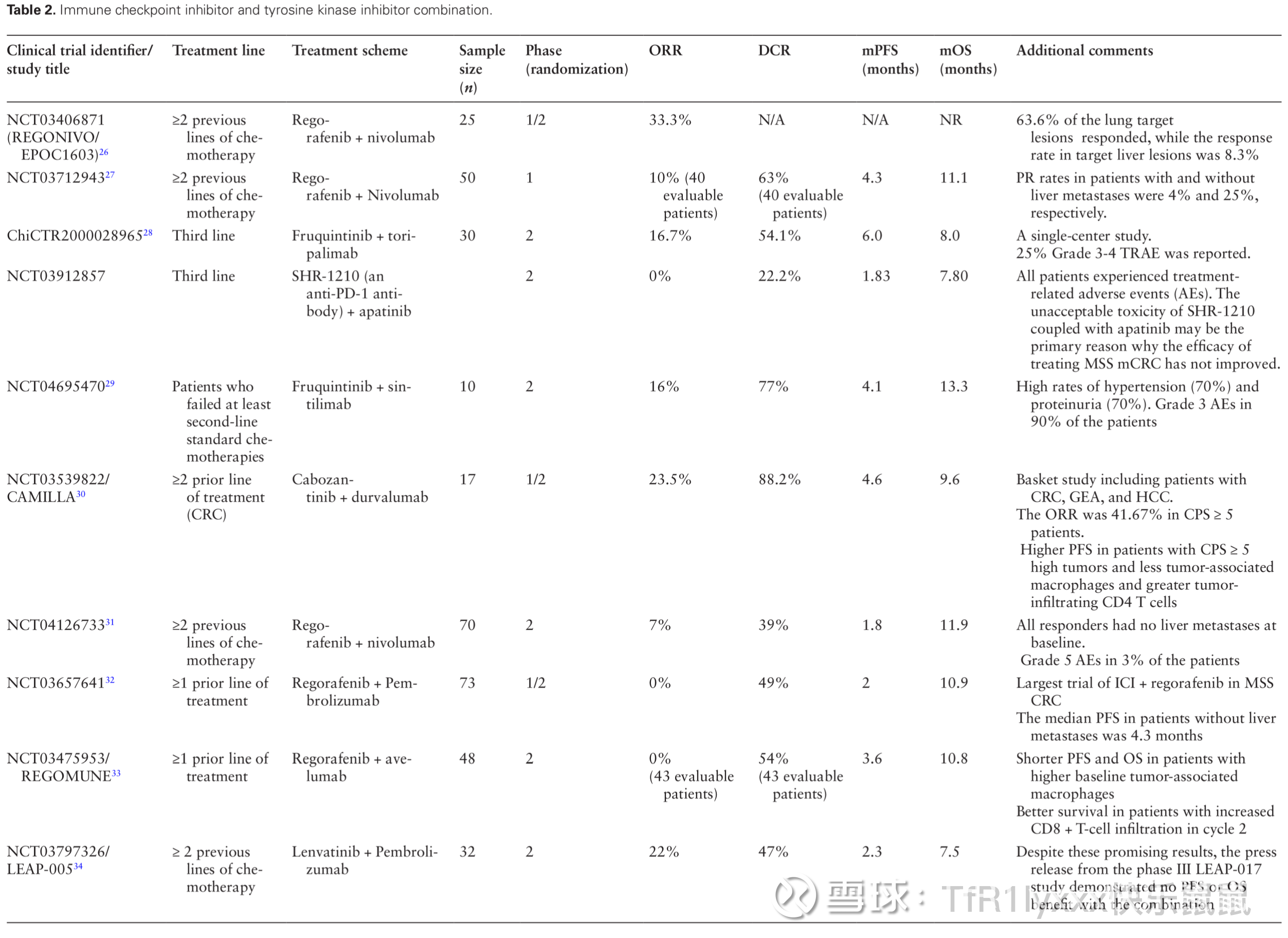
图片来源:Guven DC, Kavgaci G, Erul E, et al. The Efficacy of Immune Checkpoint Inhibitors in Microsatellite Stable Colorectal Cancer: A Systematic Review. Oncologist. 2024;29(5):e580-e600. doi:10.1093/oncolo/oyae013
接着是在免疫检查点抑制剂与化疗组合中,三项研究在二线或更晚阶段使用卡培他滨或呋喃氟尿嘧啶-替吡嘧啶(TPI),而四项研究在一线使用化疗组合。五项研究使用贝伐单抗联合化疗和ICIs。AtezoTRIBE和Checkmate 9×8研究为随机II期研究,其余为单臂I/II期研究。这些随机研究在一线纳入了MSI-H和MSS CRC患者,主要终点为PFS。在MSS亚组中,两项研究的主要结果均为阴性。在Checkmate 9×8研究中,根据CMS亚型的亚组分析显示,在CMS1或CMS3疾病患者中,12个月随访后PFS有所改善。最后,在MEDITREME试验的初步结果中,FOLFOX联合度伐利尤单抗(PD-L1)和曲美木单抗(CTLA-4)作为一线治疗的患者ORR为61%,KRAS突变型CRC患者的PFS为8.4个月。
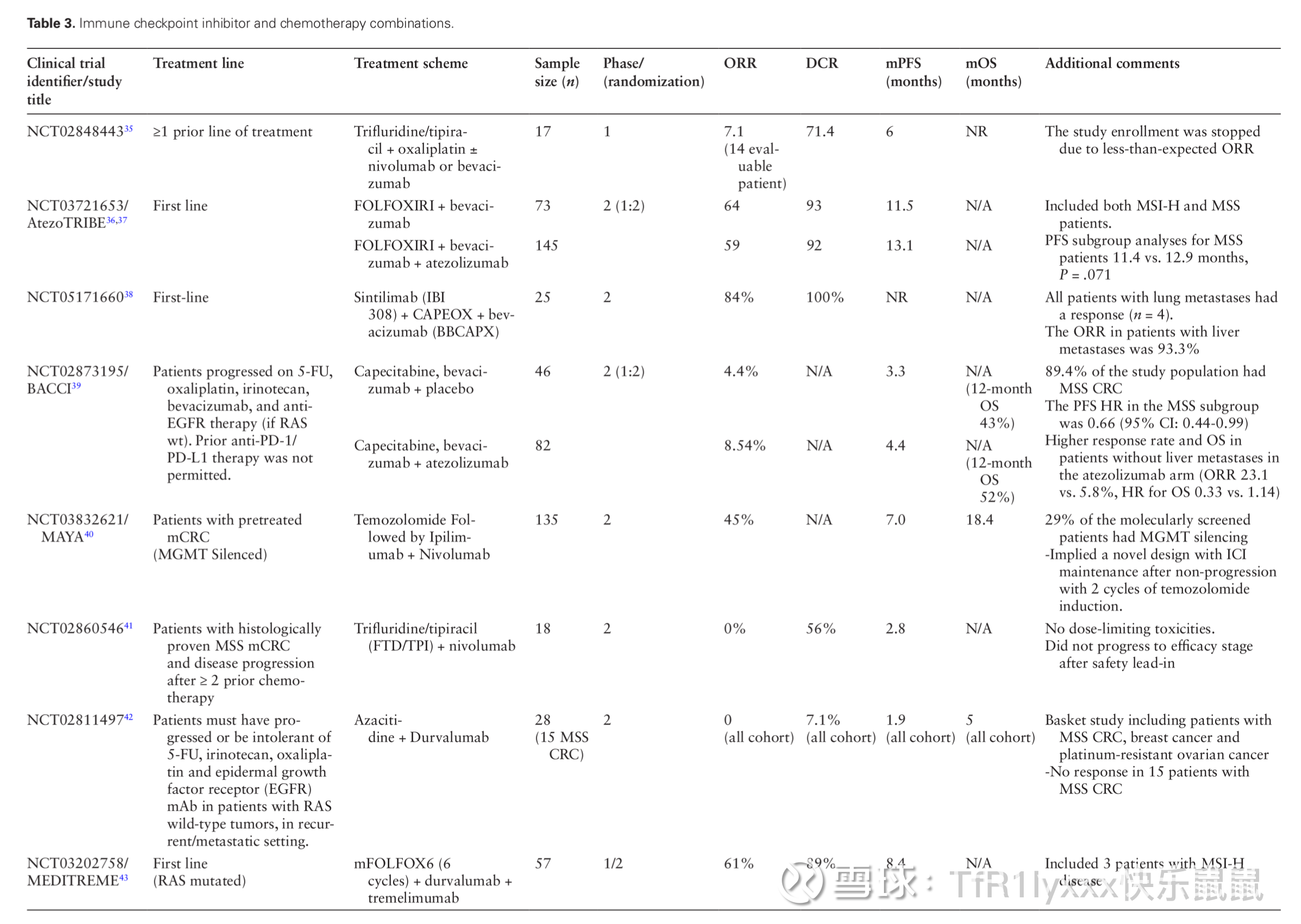
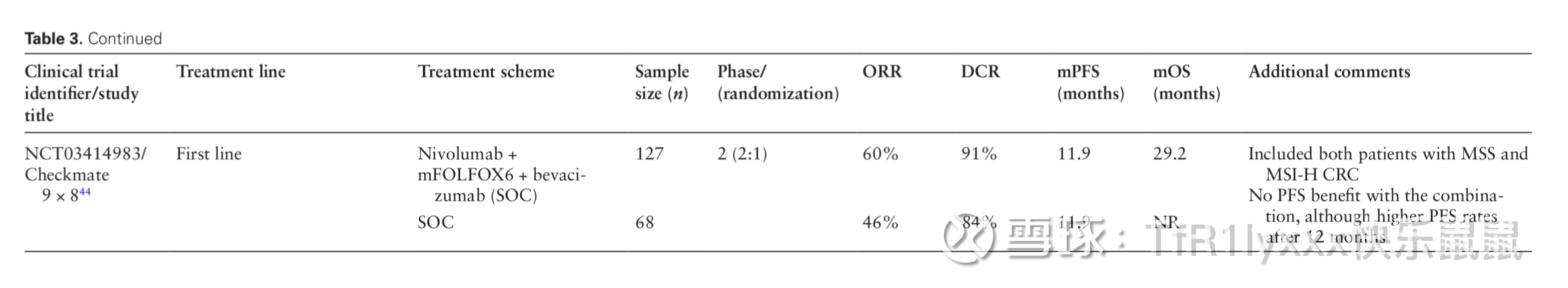
图片来源:Guven DC, Kavgaci G, Erul E, et al. The Efficacy of Immune Checkpoint Inhibitors in Microsatellite Stable Colorectal Cancer: A Systematic Review. Oncologist. 2024;29(5):e580-e600. doi:10.1093/oncolo/oyae013
当然除了ICI单药、ICI-TKI和ICI化疗组合外,还有一些其他药物的组合。如BRAF或MEK抑制剂在4项MSS CRC患者的研究中与ICIs联合测试。在早期研究之一中,康奈非尼(BRAF V600突变)、西妥昔单抗(EGFR)和O药的组合在化疗耐药的不可切除或转移性MSS、BRAF-V600E突变型CRC患者中显示ORR为45%,而在IMblaze 370研究中,阿替利珠单抗(PD-L1)联合考比替尼(BRAF V600突变)在既往治疗的转移性MSS CRC患者中的ORR为3%。
总结一下背景,具有微卫星稳定(MSS)的结直肠癌(CRC)患者由于治疗选择有限和疾病的高发率,是ICI(免疫检查点抑制剂)临床试验的重要靶向人群。然而,不同于热肿瘤,MSS CRC中ICI单药疗法的有效性在先前的临床试验中被发现是有限的,尤其是在疾病晚期,大多治疗方式ORR都小于20%,少部分在20%-50%之间,极少更高。与ICI单药疗法和ICI+ICI组合的有限疗效相比,ICI与抗VEGF药物的组合在多项研究中显示了不同的结果。VEGF通路在肿瘤微环境(TME)中起着创造和维持免疫抑制的关键作用。肿瘤相关巨噬细胞通过VEGF的过度表达,导致TGF-β分泌增加、上皮-间质转化激活以及树突状细胞成熟受损。这些因素可能导致TME中的免疫耗竭,从而降低ICI的疗效。因此,联合抗VEGF药物与ICI以产生协同的免疫激活成为提高ICI疗效的工具。VEGF信号在CRC细胞系的迁移和侵袭中起作用,VEGF的耗竭显著降低了表皮生长因子受体(EGFR)、cMET以及磷酸化的粘附斑激酶的水平,这些都是侵袭和运动的重要因素。此外,VEGF水平的增加与肝转移相关,抑制VEGF可减弱STAT3的磷酸化、增殖和转移。肝转移是CRC转移性患者中最常见的转移部位,并且在多项试验中,肝转移与MSS CRC患者对ICI的耐药性相关。这表明肝转移可能具有超越VEGF信号增加的其他生物学特征,这些特征会影响免疫反应并削弱抗肿瘤免疫力。考虑到这些因素,在没有肝转移的患者中靶向VEGF通路并结合ICI具有强大的生物学合理性。
以上这都为康方生物AK112的使用留下了空间留下了未被满足的临床需求,有理由相信AK112会成为最好的MSS CRC的ICI治疗基石。那么至于AK117,在这里我认为是放大AK112的作用,和AK112相辅相成,这一点我在“中国下一家Biopharma康方生物的登阶之路(含中报简析)” 网页链接 中有写过,AK112+AK117是血管正常化治疗+特异性免疫ICI+非特异性ICI,AK112是血管正常化治疗+主要靶向特异性免疫通路中的T细胞的PD-1的双特异性抗体药物,这一部分在我之前两篇文章“从AK112看康方生物对目前的免疫治疗联合血管正常化治疗的未满足领域的补充和基石药物的迭代” 网页链接 和“补充一下为什么说AK112满足了之前未被满足的免疫治疗+血管正常化治疗的需求。” 网页链接 都有详细介绍,可以说在这一领域康方的AK112属于独领风骚。而AK117这一药物我也详细写文章解读过“历经风浪的CD47:AK117的优势究竟在哪里?” 网页链接 它的原理则是靶向在非特异性免疫中的CD47-SIRPα这一重要通路,促进巨噬细胞等吞噬细胞对肿瘤细胞的吞噬,AK117在这一领域也是全球第一梯队,此临床也是CD47靶点在实体瘤领域的全球首个三期。作用上AK117阻断CD47-SIRPα相互作用可以有效促进巨噬细胞等吞噬细胞对肿瘤细胞的吞噬,并通过抗原呈递细胞将肿瘤抗原处理并交叉呈递给T细胞,从而激活适应性免疫反应。此外,阻断CD47还可以促进其他免疫细胞向肿瘤部位的募集,以协同增强先天性和适应性免疫反应,CD47阻断还通过树突状细胞触发T细胞反应,激活适应性免疫系统,从而协同AK112更好的发挥作用。
那么这个时候再让我们看一下康方生物AK112+AK117在转移性结直肠癌一线(除 1 例患者状态不明外,其余患者均为 MSS)治疗的 2 期研究数据。患者被1比1随机分配接受 FOLFOXIRI + 依沃西 (A 组) 或 FOLFOXIRI +依沃西 +莱法利 (B 组) 治疗,最多 8 个周期,然后用 5-氟尿嘧啶 +依沃西联合 (B 组) 或不联合莱法利 (A 组) 进行维持治疗。主要终点是客观缓解率 (ORR) 和安全性。A 组的 ORR 为 81.8%(18/22),B 组的 ORR 为 88.2%(15/17)。这两组的疾病控制率(DCR)均为 100%。中位无进展生存期(PFS)和总生存期尚未成熟。A 组 9 个月的 PFS 率为 81.4%(95% CI:52.1%-93.7%),B 组则为 86.2%(95% CI:55%-96.4%)。A 组有 18 名患者(81.8%) B 组有 18 名患者(100%)出现至少一次治疗相关不良事件 (TRAE);只有B 组中有 1 名患者因 TRAE 停止治疗。A 组中有 12 名 (54.5%) 患者 B 组中有 8 名 (44.4%) 患者出现过 ≥3 级的 TRAE,最常见的 3/4 级 TRAE包括中性粒细胞计数减少、白细胞计数减少、腹泻和高血压。那么可以看到在安全性尚可的情况下,AK112+AK117实现了对现有疗法大多治疗方式(ORR都小于20%,少部分在20%-50%之间,极少更高)的碾压,那么有人说AK117是不是没用了呢?其实也并非如此,首先AK112效果就已经很好了,AK117能再提升一点就已经很好了,另外AK117属于纯粹的免疫治疗,有可能会在比较靠后的时间节点的OS上显现出自己更大的优势,也是非常值得期待的。也是很期待康方生物的AK112+AK117在MSS CRC的后续三期临床尽快的推进,以及后续的数据。
写在后面,看到AK112和AK117能够在占比至少80%且有着巨大的未被满足的临床需求的MSS CRC能取得这样的疗效真的是很让人高兴的。结直肠癌作为不比肺癌少多少患者的适应症,MSS CRC更是一片对AK112+AK117来说的蓝海,再结合SMMT高层最近的发言,对MSS CRC未来global 临床的看好,可以预见,AK112+AK117的组合在MSS CRC的治疗将成为肺癌后的AK112的另一大出海方向,这一组合也拥有着对MSS CRC治疗的迭代潜力,让人万分期待。
本文仅作学术分享,不构成投资建议。本文部分内容出自Guven DC, Kavgaci G, Erul E, et al. The Efficacy of Immune Checkpoint Inhibitors in Microsatellite Stable Colorectal Cancer: A Systematic Review. Oncologist. 2024;29(5):e580-e600. doi:10.1093/oncolo/oyae013,The efficacy and safety of ivonescimab with or without ligufalimab in combination with FOLFOXIRI as first-line (1L) treatment for metastatic colorectal cancer (mCRC),康方生物官网,以及SMMT官网,如有侵权,请联系删除。风险提示:本文所提到的观点仅代表个人的意见,所涉及标的不作推荐,据此买卖,风险自负。谢谢大家,也希望可以和大家多多交流,互相学习。$康方生物(09926)$ @雪球创作者中心 #雪球星计划#










